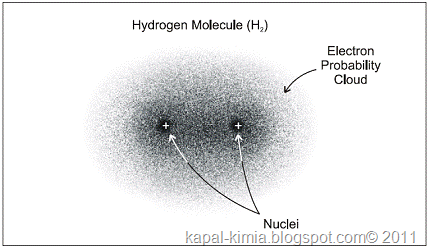
Mengapa hidrogen memiliki 3 isotop dan bagaimana terbentuknya?
Isotop adalah dua atau lebih nuklida yang nomor atomnya sama tetapi nomor massanya berbeda. Secara kimiawi, isotop memperlihatkan sifat yang sama, tetapi sebagai inti atom akan merupakan unsur yang berbeda. Hal ini disebabkan karena perbedaan jumlah neutron meskipun jumlah protonnya sama.
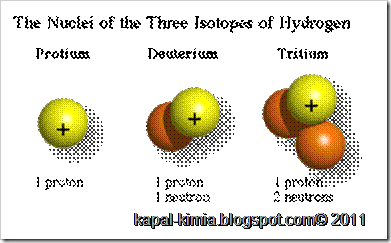
Diantara isotop, yang memiliki sifat radioaktif disebut isotop radioaktif, sedang yang tidak radioaktif disebut isotop stabil. Misalnya hidrogen (H-1) (proton 1, neutron 0), deuterium (H-2) (proton 1, neutron 1), tritium (H-3) (proton 1, neutron 2) semuanya adalah isotop hidrogen. Diantara ketiganya, tritium adalah isotop radioaktif..
1H adalah isotop hidrogen yang paling melimpah, memiliki persentase 99.98% dari jumlah atom hidrogen. Oleh karena inti atom isotop ini hanya memiliki proton tunggal, ia diberikan nama yang deskriptif sebagai protium, namun nama ini jarang sekali digunakan.
2H, isotop hidrogen lainnya yang stabil, juga dikenal sebagai deuterium dan mengandung satu proton dan satu neutron pada intinya. Deuterium dan Tritium keduanya digunakan sebagai bahan bakar reaktor fusi nuklir. Satu atom Deuterium ditemukan di sekitar 6000 atom-atom hidrogen.Deuterium tidak bersifat radioaktif, dan tidak memberikan bahaya keracunan yang signifikan. Air yang atom hidrogennya merupakan isotop deuterium dinamakan air berat. Deuterium dan senyawanya digunakan sebagai penanda non-radioaktif pada percobaan kimia dan untuk pelarut 1H-spektroskopi NMR. Air berat digunakan sebagai moderator neutron dan pendingin pada reaktor nuklir. Deuterium juga berpotensi sebagai bahan bakar fusi nuklir komersial.Sedangkan pembentukan deuterium adalah:
dua inti hidrogen 1H (proton) untuk kemudian membentuk satu inti deuterium 2H. Pembentukan inti deuterium memaksa sebuah proton berubah menjadi netron dalam proses peluruhan beta dengan melepaskan sebuah positron dan sebuah neutrino:
1H+1H → 2H+e++νe+0,16 MeV (setidaknya 0,53 MeV dibawa oleh neutrino)
Pelepasan neutrino pada langkah ini membawa energi lebih dari 0,53 MeV. Langkah ini sebenarnya adalah reaksi yang tidak biasa dibandingkan dengan kebanyakan proses-proses fusi lainnya. Untuk menghasilkan 2H, proton-proton harus mengalami peluruhan β+ pada saat titik terdekat mereka. Proses ini diatur oleh interaksi lemah dan sangat jarang terjadi. Oleh karenanya reaksi pertama memiliki penampang nuklir (cross-section) yang sangat kecil dan sebuah proton harus menunggu rata-rata selama 10,9 tahun untuk berfusi dengan sesamanya dalam membentuk deuterium.
Positron yang terbentuk kemudian segera musnah oleh sebab interaksi dengan sebuah elektron. Energi massa mereka dibawa oleh dua foton sinar gamma:
e++e- → 2γ+1.02 MeV
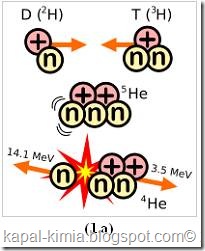
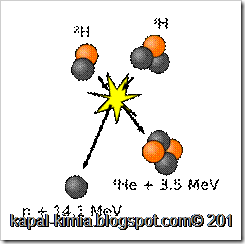
Tritium terjadi secara natural selama sinar kosmik berinteraksi dengan gas atmosfer. Reaksi dari Tritium menghasilkan 4,8MeV neutron yang berkecepatan tinggi (lebih besar dari 4MeV) berinteraksi dengan Nitrogen di atmosfer.
Karena Tritium memiliki waktu paruh yang relatif pendek, tritium diproduksi dalam hal ini tidak terakumulasi diatas skala waktu geologi. Dan kelimpahan alaminya tidak dapat diperhatikan. Tritium dibuat dalam reaktor nuklir dengan aktivasi neutron dari Lithium – 6. Kemungkinan dengan beberapa energi reaksi eksotermik 4.8 MeV,
Dengan neutron yang berenergi tinggi dapat juga membuat tritium dari litium – 7 dalam reaksi endotermik meemrlukan 2.466 MeV. Ditemukan oleh Castle Bravo pada tahun 1954 dan tidak menghasilkan hasil yanbg bagus setelah di test.
Irradiasi neutron berenergi tinggi dari boron – 10 juga bisa menghasilkan tritium.boron – 10 umumnya menghasilkan tritium jika menangkap litium dan partikel alfa tunggal.
Dihasilkan juga dari peluruhan helium – 3.










![clip_image002[14] clip_image002[14]](http://lh5.ggpht.com/_QlyxjDmvSbs/TaOeVoa_W-I/AAAAAAAAAN0/sQx1xkV0u_c/clip_image002%5B14%5D_thumb%5B6%5D.jpg?imgmax=800)
![clip_image002[5] clip_image002[5]](http://lh3.ggpht.com/_QlyxjDmvSbs/TaOKTuUNRsI/AAAAAAAAANE/JWm_b4SP4BQ/clip_image002%5B5%5D_thumb%5B1%5D.jpg?imgmax=800)



